
Actas del Congreso Nacional de
Tecnología Aplicada a Ciencias
de la Salud



Actas del Congreso Nacional de Tecnología Aplicada a Ciencias de la Salud Vol. 5, 2023
Se presenta una propuesta experimental y avances preliminares, para realizar un prediagnóstico temprano del Glaucoma con el análisis de señales cerebrales obtenidas por estimulación visual. En esta propuesta se utiliza una Diadema EMOTIV EPOC FLEX de 32 canales, para la detección de la respuesta cerebral ante un estímulo visual desplegado en una pantalla. Este estímulo visual es un nuevo procedimiento desarrollado en lenguaje Python y diseñado con base en la prueba óptica de campimetría, que es un proceso estándar para el diagnóstico de esta neuropatía. Con el análisis y procesamiento de estas señales se espera encontrar una metodología para un prediagnóstico temprano de esta grave enfermedad.
Palabras claves: Campimetría, Procesamiento de señales cerebrales, Prediagnóstico de Neuropatías ópticas
An experimental proposal and preliminary advances are presented to perform an early pre-diagnosis of Glaucoma with the analysis of brain signals obtained by visual stimulation. A 32 channels EMOTIV EPOCFLEX Headband is used to detect the brain response to a visual stimulus displayed on a screen. This visual stimulus is a new procedure developed in Python language and designed based on the optical campimetry test, which is a standard process for the diagnosis of this neuropathy. With the analysis and processing of brain signals, it is expected to find a methodology for an early pre-diagnosis of this serious disease.
Key words: Campimetry, Brain signal processing, Pre-diagnosis of Optic Neuropathies
El Glaucoma es una enfermedad ocular crónica considerada la primera causa de pérdida irreversible de visión, la segunda causa más común de ceguera en el mundo, y según la OMS se encuentra entre las principales causas de discapacidad. Se estima que hay cerca de 80 millones de personas enfermas de glaucoma en el mundo y para el 2024 se incrementará este número hasta 111 millones. Aproximadamente la mitad de estas personas desconocen que tienen esta enfermedad.
En los países desarrollados esta falta de diagnóstico se debe a la falta de información sobre la enfermedad, pero en los países con altos índices de pobreza la razón es la falta de acceso a servicios de salud ocular [1] [2] [3]. Se trata de una enfermedad irreversible para la que no hay cura, pero es posible controlar su progresión con un diagnóstico precoz y tratamiento adecuado [4].
Al respecto existen varias técnicas de diagnóstico reportadas en la literatura utilizadas para el diagnóstico de Glaucoma, mismas que se mencionan a continuación.
El glaucoma se ajusta a un grupo de alteraciones visuales que tienen en común la pérdida de los axones de las células ganglionares, generando una atrofia óptica progresiva ocasionando daño gradual en del campo visual y en la anatomía del nervio óptico. La presión intraocular es un factor clave para el diagnóstico de muchos de los subtipos de glaucoma, siendo este parámetro el que directamente se trata o se intenta controlar. El tipo de glaucoma primario de ángulo abierto (GPAA) es el que se presenta con mayor regularidad, principalmente en personas adultas a partir de los 40 años [5].
Los métodos comúnmente utilizados para la detección del glaucoma son: Tanometría, Gonioscopía, Oftalmoscopía, Perimetría automática estándar, Tomografía de coherencia óptica (OCT) y Paquimetría. Sin embargo, estas pruebas requieren de instrumentación especial por lo que generalmente solo están disponibles en clínicas oftalmológicas, los equipos son físicamente invasivos para los pacientes y de alto coso.
La Perimetría/Campimetría es el único método capaz de cuantificar la pérdida funcional del campo visual, no es invasivo y además es el más utilizado para realizar el diagnóstico de glaucoma. Sin embargo, presenta altos costos tanto para el paciente cómo para el médico, y otras características poco deseables principalmente para los pacientes con Glaucoma, por ejemplo las variables ambientales (cambios de temperatura y presión atmosférica) y fisiológicas (ritmo circadiano, niveles de oxígeno y glucosa en sangre, fluctuaciones diarias en la atención, presión arterial, presión intracraneal, estrés). Lo anterior sucede porque en los pacientes con glaucoma el nervio óptico ya se encuentra lesionado, y estas áreas parcialmente dañadas trabajan en su límite metabólico [6], [7].
En los últimos años se está utilizando la electrofisiología neuronal como una de las potenciales herramientas para el diagnóstico de neuropatías ópticas. Esta metodología es una prueba No invasiva, presenta mayor resolución temporal incluso que la resonancia magnética, no tiene las limitaciones externas mencionadas con anterioridad, puede resultar sumamente precisa, puede dar información funcional del sistema de visión, podría ser más económico y accesible (ya que los equipos de encefalografía de pocos electrodos son en general de bajo costo), entre otras ventajas. Sin embargo, aún no se utiliza de forma rutinaria por la falta de criterios claros de diagnóstico basados en hallazgos experimentales, falta de biomarcadores específicos o procesamientos bien documentados de las señales. También impactan los inconvenientes asociados con los métodos tradicionales de EEG (tiempos de configuración muy largos, portabilidad limitada, preparación incómoda de la cabeza, uso de pastas, geles, soluciones salinas etc) falta de integración entre los estímulos visuales y el EEG, entre otros [1], [8], [9].
Los Potenciales Visuales Evocados (VEP por sus siglas en inglés) son pruebas electrofisiológicas neuronales que registran las señales de regiones específicas del cerebro provocadas por la estimulación del sistema de visión. Los foto-receptores del ojo se encargan de convertir los estímulos visuales en señales eléctricas que son procesadas por el cerebro y posteriormente tales VEP son medidos y analizados para encontrar biomarcadores de la trayectoria desde la retina, nervio óptico, quiasma óptico, hasta diversas regiones cerebrales. Los estímulos visuales usados se clasifican en destellos luminosos o “Flash” y cambios de patrones o “Pattern”. Hay una gran variedad de propuestas del estímulo visual, desde el típico tablero de ajedrez con cambios en color de cuadros bancos-negros, hasta el estado de reposo con ojos cerrados. Teóricamente se manejan tres trayectorias del sistema de visión humana, Magno-celular, Parvo-celular y Konio-celular, las cuales se pueden activar selectivamente con un adecuado y cuidadoso diseño del estímulo visual [8], [9] [10], [11], [12].
Esta técnica de VEP´s se ha comparado con diversos procedimientos estándares, usados para el diagnóstico de Glaucoma, uno de los más modernos es la Tomografía de Coherencia (OCT). Así se han encontrado claras muestras de diferencias evidentes entre las señales de personas sanas, con personas diagnosticadas con Glaucoma. En esos estudios mayormente se realizan análisis en el tiempo y en menor grado en la frecuencia. También se usan diferentes números de electrodos, que van desde 3 electrodos en la región occipital, hasta 64 electrodos que cubren casi todas las regiones cerebrales. Estos parámetros entre otros se definen para la propuesta presentada en este trabajo [6], [10], [11], [13].
Sin embargo, hasta el momento no existe una prueba de identificación del glaucoma con la anticipación, eficacia, accesibilidad, fácil de aplicar y cómoda de interpretar; esto dadas las características de la población con mayor afectación; es decir, enfermos no diagnosticados principalmente de países en vías de desarrollo, sin un sistema de salud ocular adecuado, sin el poder adquisitivo suficiente para realizarse las pruebas oculares o la visita al oftalmólogo.
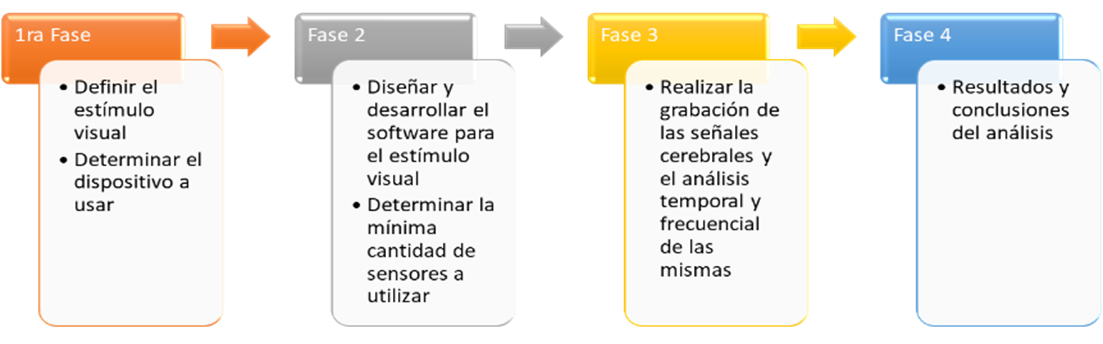
Figura 1. Fases del desarrollo del proyecto
Por lo tanto, en este trabajo se presentan las primeras fases del diseño e implementación de un procedimiento clínico que permita la realización de un pre-diagnóstico temprano del Glaucoma, mismo que está basado en el análisis de señales cerebrales obtenidas por estimulación visual. El procedimiento propuesto consta de cuatro fases, mismas que se describen esquemáticamente en la figura 1.
A continuación, se describen las características del desarrollo de cada una de las fases.
3.1 Software
3.1.1 Diseño: Esta basado en el examen de Campimetría computarizada por las ventajas que este presenta y que se mencionan en la sección 2 de este trabajo. Está planteado para realizar 3 pruebas a cada uno de los participantes del experimento una de las cuales está ejemplificada en el diagrama de la figura 3. Así, se utiliza un fondo amarillo y un estímulo azul tal como recomiendan algunos estudios actuales ya que demuestran que esta condición es específica para enfermos de glaucoma en estado temprano [13], [14]. Además, se marca en el centro de la pantalla un punto negro como guía de enfoque durante toda la prueba. Se deben obtener los datos básicos de la persona que se somete a la prueba (nombre, edad, uso o no de anteojos)
3.1.2 Desarrollo: El software se encuentra desarrollado en Python. Con ayuda de librerías como numpy para la creación de arreglos numéricos y PyGame para animaciones. En la primera prueba se presenta el fondo amarillo y el punto central de enfoque durante 1 minuto. En la 2da prueba, se muestra la misma pantalla amarilla, pero en esta ocasión un cuadro azul se mueve realizando un recorrido en los ejes “x” y “y”. Se barre toda la pantalla de forma aleatoria sin que se repita una sola trayectoria. La tercera y última prueba, consiste en realizar los mismos barridos que en la prueba 2, pero en esta ocasión se le solicita al usuario que cada que vea que el cuadro termina el barrido presione la tecla espaciadora, lo que almacenará de manera automática en una hoja de Excel, sus datos, coordenadas “x” y “y” y el tiempo en el que presiono el botón (Fig. 2).

Figura 2. Muestra de la pantalla del diseño de software y de la diadema EMOTIV FLEX
3.2 Dispositivo
Se utiliza una diadema “EMOTIV EPOC Flex Wireless saline models” de 32 canales con muestreo secuencial simple de 128 sps, 14 bits de resolución, ancho de banda de 0.2 – 45 Hz., rango dinámico de ±4.12 mV [15].
3.3 Toma de datos
Después de una revisión exhaustiva de la literatura sobre el número y posición de los electrodos en las diferentes regiones del cerebro se realiza una tabla que contiene las etapas en la que se enfocaron los esfuerzos para realizar los análisis y procesamiento de las señales cerebrales obtenidas de la aplicación del experimento. Estas fases se muestran en la Tabla I. [8], [9], [16], [11], [12], [13], [16], [17], [18], [19], [20].
Tabla I. Etapas de análisis y procesamiento de señales de electrodos de EEG
| Método | Electrodos | Etapa de Análisis | |
|---|---|---|---|
| VEP | Oz (RJ) | Occipital central | Primer Etapa |
| O1 (LL) | Occipital Izq | ||
| O2 (RL) | Occipital Derecha | ||
| VEP / otros | Cz (LB) | Central | |
| Fz (RK) | Frontal central | ||
| FC1 (LC) | Frontal central izq | ||
| FC2 (RC) | Frontal central Derecho | ||
| Otros | Pz (LJ) | Parietal central | Segunda Etapa |
| CP1 (LP) | Parietal central Izq | ||
| CP2 (RP) | Parietal central Derecho | ||
| F3 (LF) | Frontal superior Izq | ||
| F4 (RF) | Frontal superior Derecho | ||
| C3 (LA) | Central Izq | Tercer Etapa | |
| C4 (RA) | Central Derecho | ||
| P3 (LN) | Parietal superior Izq | ||
| P4 (RN) | Parietal superior Derecho |
Hasta el momento se han realizado 8 experimentos para familiarizarse con el dispositivo EEG. Se realizó la primera fase de toma de datos a 7 voluntarios, 2 corridas por usuario, una de ellas en pantalla y la otra en un proyector para ampliar el campo de visión. Se grabó video y datos de EEG de los 7 usuarios, sin embargo, se discriminaron las pruebas de 2 usuarios debido a baja calidad en el EEG grabado. Se está trabajando en el acondicionamiento de los datos.
En esta dirección se están revisando y determinando los datos para análisis (fracciones temporales de cada experimento, de cada usuario y de cada corrida) según: el nivel de conexión que se tenga de los electrodos, comportamiento del usuario de la diadema.
Se sabe que en la literatura se realizan 3 tipos de análisis de datos: el temporal, el frecuencial y el de sincronicidad. El más utilizado para los VEP es el temporal, sin embargo, debido a la nueva propuesta de estímulo visual que se está realizando en este trabajo, se determinó que un análisis en la frecuencia y en la sincronización de señales es el más adecuado.
Los primeros resultados obtenidos de las señales cerebrales muestran variaciones en frecuencia, consistentes con los diferentes estímulos visuales a los que se sometieron los voluntarios. Esto significa que el análisis se enfocará en el comportamiento de las bandas de frecuencia Low Beta (12-16Hz) y Alpha(8-12Hz) y potencialmente se espera establecer los biomarcadores esperados (fig.3).
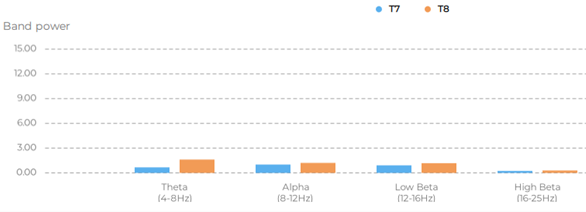
Figura 3. Muestra de las potencias de señales de los electrodos T7 y T8 en el desarrollo del experimento 2 (movimiento en campo visual periférico sin actividad)
También se observan resultados prometedores en cuanto al nivel de sincronización de las señales capturadas por los 7 electrodos analizados en esta primera etapa. Como se puede observar en la figura 4, existe una clara sincronización entre las señales de las regiones Frontal – Central (izquierda y derecha) y la región Temporal (izquierda derecha). En cambio, esta sincronización no tan clara en la región occipital. Lo que indica que un análisis minucioso en esta dirección va a comprobar los resultados esperados.
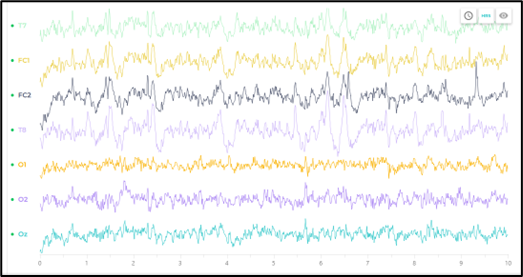
Figura 4. Muestra de las señales censadas por los electrodos de las regiones: Temporal, Frontal-Central (FC1, FC2), y Occipital (Oz, O1, O2 en el desarrollo del experimento 2 (movimiento en campo visual periférico sin actividad)
Con estas observaciones llegamos a las conclusiones que se presentan en la siguiente sección.
Con base en la revisión del estado del arte, y los resultados obtenidos hasta el momento se puede concluir que existe una relación entre el estímulo del sistema de visión periférico, las señales cerebrales y la enfermedad del Glaucoma, también podemos afirmar que es factible un prediagnóstico del glaucoma en estado temprano con el análisis y procesamiento meticuloso de las señales cerebrales.
El objetivo del proyecto es motivado por los datos demostrados en este artículo, establecer un proceso metodológico para realizar un diagnóstico temprano del glaucoma usando señales cerebrales provocadas por estímulos en el sistema de visión. Sin embargo, a largo plazo se pretende sistematizar este procedimiento y finalmente realizar un prototipo de bajo costo accesible para el sector de la población más vulnerable.